
Hai Quipperian, saat belajar Fisika kamu sudah dikenalkan dengan istilah kelajuan atau kecepatan, kan? Ternyata, di Kimiapun juga ada kelajuan lho. Bedanya, kelajuan di Kimia berlaku untuk menunjukkan seberapa cepat suatu reaksi berlangsung. Istilah ini lebih dikenal sebagai laju reaksi. Bagaimana cara mencari laju reaksi itu? Pada artikel ini, Quipper Blog akan membahas beberapa contoh soal terkait laju reaksi. Yuk, simak selengkapnya!
Contoh Soal 1
Sebanyak 22,2 gram CaCl2 dilarutkan ke dalam 4 liter air. Molaritas CaCl2 tersebut adalah …. (Ar Ca = 40, Ar Cl = 35,5)
- 0,05 M
- 0,5 M
- 0,02 M
- 0,2 M
- 0,04 M
Pembahasan:
Diketahui:
m = 22,3 gr
V = 4 liter
Ditanya: M =…?
Jawab:
Mula-mula, kamu harus mencari banyaknya mol CaCl2
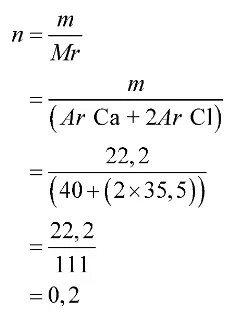
Selanjutnya, tentukan molaritas CaCl2
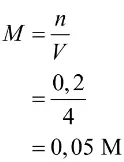
Jadi, molaritas CaCl2 adalah 0,05 M.
Jawaban: A
Contoh Soal 2
Gas SO3 terurai sempurna menjadi SO2 dan O2 di dalam suatu bejana yang volumenya 8 liter. Reaksi penguraian tersebut berlangsung selama 16 menit. Jika mol awal SO3 64 mol, maka laju penguraian SO3nya adalah
- 0,2 M/menit
- 0,5 M/menit
- 0,01 M/menit
- 2 M/menit
- 5 M/menit
Pembahasan:
Diketahui:
V = 8 liter
n = 64 mol
t = 16 menit
Ditanya: v =…?
Jawab:
Mula-mula, kamu harus mencari molaritas SO3
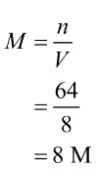
Di soal tertulis bahwa SO3 terurai sempurna. Artinya, semua SO3 berubah menjadi SO2 dan O2. Dengan demikian, M = ∆M
Selanjutnya, tentukan laju reaksi dengan persamaan berikut
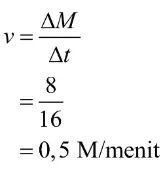
Jadi, laju penguraian SO3 adalah 0,5 M/menit.
Jawaban: B
Contoh Soal 3
Suatu zat mengalami penguraian dengan laju 0,4 M/menit. Jika reaksi tersebut berlangsung selama 5 menit, konsentrasi awal zat tersebut adalah
- 5 M
- 0,5 M
- 3 M
- 2 M
- 0,2 M
Pembahasan:
Diketahui:
v = 0,4 M/menit
∆t = 5 menit
Ditanya: ∆M =…?
Jawab:
Untuk mencari konsentrasi awal, gunakan persamaan laju reaksi.

Jadi, konsentrasi awal zat tersebut adalah 2 M
Jawaban: D
Contoh Soal 4Suatu percobaan menghasilkan data seperti berikut.
| Konsentrasi P (M) | Waktu (detik) |
|---|---|
| 0 | 0 |
| 0,2 | 10 |
| 0,6 | 20 |
| 0,8 | 30 |
Laju reaksi rata-rata pada 20 detik pertama adalah
- 0,3 M/detik
- 0,02 M/detik
- 0,03 M/detik
- 0,04 M/detik
- 0,4 M/detik
Pembahasan:
Laju reaksi rata-rata 20 detik pertama bisa kamu dapatkan melalui perbandingan antara konsentrasi dan selang waktunya seperti berikut.

Jadi, laju rata-rata 20 detik pertama adalah 0,03 M/detik.
Jawaban: C
Contoh Soal 5
Suatu reaksi berlangsung seperti persamaan berikut.
2P(g) + Q2(g) → 2PQ(g)
Reaksi tersebut menghasilkan data seperti berikut.
| Konsentrasi P (M) | Waktu (detik) |
|---|---|
| 0,3 | 0 |
| 0,25 | 8 |
| 0,2 | 16 |
| 0,15 | 24 |
Laju reaksi rata-rata pembentukan gas PQ dalam selang waktu 8 sampai 16 detik adalah
- 0,00625 M/detik
- 0,0625 M/detik
- 6,25 M/detik
- 0,00725 M/detik
- 0,0725 M/detik
Pembahasan:Mula-mula, kamu harus menentukan laju reaksi gas P yang merupakan reaktan. Oleh sebab itu, konsentrasi gas P akan terus berkurang, sehingga perubahan konsentrasinya bernilai negatif.

Dengan demikian, laju reaksi rata-rata pembentukan gas PQ pada selang waktu 8 sampai 16 detik adalah sebagai berikut.

Jadi, laju reaksi rata-rata pembentukan gas PQ dalam selang waktu 8 sampai 16 detik adalah 0,00625 M/detik.
Jawaban: A
Contoh Soal 6
Perhatikan grafik hubungan antara konsentrasi dan waktu berlangsungnya reaksi berikut.

Jika laju reaksinya 0,018 M, nilai x adalah
- 1,32 M
- 1,25 M
- 1,39 M
- 1,35 M
- 1,28 M
Pembahasan:
Berdasarkan grafik pada soal, laju reaksi ditentukan dari nilai gradien atau kemiringan garis. Dengan demikian,

Jadi, nilai x adalah 1,28 M
Jawaban: E
Contoh Soal 7
4 mol P2 dan 2 mol Q2 direaksikan ke dalam wadah 2 L dan mengikuti persamaan berikut.
2P2 + Q2 → 2P2Q
Jika persamaan laju reaksinya r = 0,1[P2][Q2], besarnya laju reaksi saat konsentrasi P2Q yang terbentuk adalah 0,8 mol adalah
- 0,08 M/detik
- 0,008 M/detik
- 0,006 M/detik
- 0,05 M/detik
- 0,04 M/detik
Pembahasan:
Mula-mula, kamu harus menuliskan reaksinya dalam bentuk M-R-S berikut.
| 2P2 | Q2 | → | 2P2Q | |
|---|---|---|---|---|
| Mula-mula | 4 | 2 | – | |
| Reaksi | 0,8 | 0,4 | 0,8 | |
| Sisa | 3,2 | 1,6 | 0,8 |
Tentukan dahulu molaritas P2 dan Q2 seperti berikut.

Lalu, substitusikan nilai [P2] dan [Q2] pada persamaan r yang tertera di soal.
r = 0,1[P2][Q2]= 0,1[0,4][0,2]
= 0,008 M/detik
Jadi, laju reaksi saat konsentrasi P2Q yang terbentuk adalah 0,8 mol adalah 0,008 M/detik.
Jawaban: B
Contoh Soal 8
Perhatikan reaksi berikut.
AB + C2 → ABC2
Reaksi di atas memiliki persamaan laju reaksi r = k[AB]2[C2]. Tentukan orde reaksi totalnya!
Pembahasan:
Sebelum menentukan orde reaksi total, kamu harus tahu dulu orde masing-masing pereaksi. Mungkin kamu bertanya-tanya, apa sih orde itu? Orde adalah pangkat dari tiap pereaksi. Dari reaksi AB + C2 → ABC2 diketahui:
- Orde reaksi AB = 2
- Orde reaksi C2 = 1
Jadi, orde reaksi totalnya adalah 2 + 1 = 3
Contoh Soal 9
Suatu reaksi berlangsung seperti persamaan berikut.
P + 2Q → R
Perhatikan data hasil percobaan berikut.
| Percobaan ke- | [P] M | [Q] M | r (M/s) |
|---|---|---|---|
| 1 | 0,2 | 0,1 | 0,04 |
| 2 | 0,1 | 0,1 | 0,02 |
| 3 | 0,1 | 0,3 | 0,18 |
Berdasarkan data di atas, tentukan persamaan laju reaksinya!
Pembahasan:
Untuk menentukan persamaan laju reaksi, kamu harus mencari orde masing-masing pereaksi
Mula-mula, buatlah permisalan, orde reaksi terhadap P adalah x dan orde reaksi terhadap Q adalah y
- Orde reaksi terhadap P bisa kamu tentukan dari persamaan ke-1 dan ke-2.
- Orde reaksi terhadap Q bisa kamu tentukan dari persamaan ke-2 dan ke-3
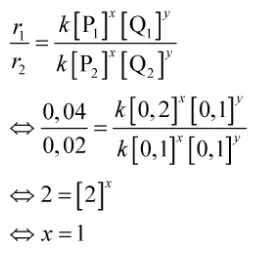

Berdasarkan perhitungan di atas, diperoleh nilai x = 1 dan y = 2. Dengan demikian, persamaan laju reaksinya adalah r = k[P][Q]2
Jadi, persamaan laju reaksinya adalah r = k[P][Q]2
Contoh Soal 10
Perhatikan data hasil percobaan berikut
| Percobaan ke- | [S] M | [T] M | r (M/s) |
|---|---|---|---|
| 1 | 0,6 | 0,25 | 0,08 |
| 2 | 0,3 | 0,25 | 0,02 |
| 3 | 0,3 | 0,5 | 0,16 |
Berdasarkan data di atas, berapakah orde reaksi totalnya?
Pembahasan:
Untuk menentukan persamaan laju reaksi, kamu harus mencari orde masing-masing pereaksi.
Mula-mula, buatlah permisalan, orde reaksi terhadap S adalah x dan orde reaksi terhadap Q adalah y.
- Mula-mula, buatlah permisalan, orde reaksi terhadap S adalah x dan orde reaksi terhadap Q adalah y.
- Orde reaksi terhadap T bisa kamu tentukan dari persamaan ke-2 dan ke-3.
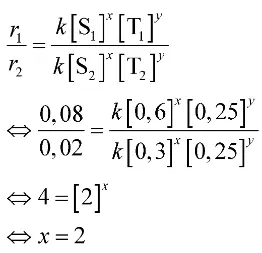
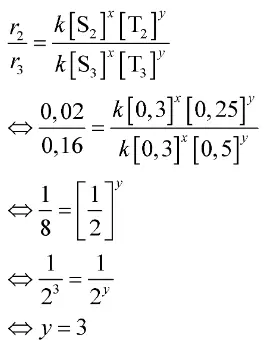
Berdasarkan perhitungan di atas, diperoleh nilai x = 2 dan y = 3. Dengan demikian, orde reaksi totalnya adalah 2 + 3 = 5.
Jadi, orde reaksi totalnya adalah 5.
Sampai sini, apakah Quipperian sudah paham cara menyelesaikan soal-soal laju reaksi?
Semoga 10 contoh soal di atas bermanfaat, ya. Untuk contoh soal lainnya bisa kamu tengok di Quipper Video. Jika belum berlangganan, yuk buruan daftar. Salam Quipper!
