
Hai Quipperian, tahukah kamu jika keberadaan senyawa kimia terasa lekat dengan kehidupan? Bagaimana tidak, hampir setiap produk yang digunakan oleh manusia selalu melibatkan senyawa kimia di dalamnya. Baik sebagai pengawet, pengental, pewarna, pemanis, dan sebagainya. Namun demikian, senyawa kimia itu sudah dipastikan keamanannya lho. Untuk membuat senyawa kimia yang aman, seorang ahli harus paham tentang tabel periodik unsur. Lantas, apa yang dimaksud tabel periodik? Yuk, simak selengkapnya!
Pengertian Tabel Periodik
Tabel periodik adalah tabel yang berisi urutan unsur sesuai dengan golongan dan periodenya. Unsur-unsur yang tertulis di dalam tabel periodik dinyatakan dalam bentuk singkatan, seperti Cu (emas), Ag (perak), Fe (besi), H (hidrogen), dan sebagainya. Proses penamaan itu mengacu pada nama ilmiah setiap unsur, Cu = cuprum, Ag = argentum, Fe = ferrum, dan sebagainya. Di dalam tabel tersebut sudah memuat pengelompokan unsur berdasarkan sifat-sifat dan bentuknya. Misalnya, unsur logam dikelompokkan dengan unsur logam. Begitu juga dengan unsur nonlogam yang dikelompokkan dengan unsur nonlogam lain. Itulah mengapa, seorang ahli kimia harus memahami betul tabel periodik ini.
Struktur Tabel Periodik
Struktur tabel periodik dibagi menjadi beberapa bagian, yaitu sebagai berikut.
1. Golongan
Golongan adalah pengelompokan unsur berdasarkan elektron valensi. Golongan bisa dilihat pada kolom vertikal di tabel periodik. Secara umum, golongan dibagi menjadi dua, yaitu golongan A dan golongan B. Golongan A biasa disebut golongan utama, sedangkan golongan B disebut golongan transisi. Jumlah seluruh golongan, baik A dan B, adalah 18. Dalam satu golongan, semakin ke bawah jari-jari atom semakin besar. Artinya, keelektronegatifan unsur semakin kecil. Lalu, apa perbedaan golongan-golongan tersebut? Yuk, check this out!
- Golongan A terdiri dari IA, IIA IIIA, IVA, VA, VIA, VIIA, dan VIIIA. Adapun nama-nama IUPAC untuk setiap golongan itu adalah sebagai berikut.
- Golongan I A (logam alkali) terdiri dari unsur-unsur yang memiliki elektron valensi 1. Unsur-unsur yang termasuk golongan ini adalah H, Li, Na, K, Rb, Cs, dan Fr. Unsur H bukan termasuk logam meskipun berada di golongan logam alkali. Golongan I A ini berada di blok s karena elektron valensinya berada di subkulit s.
- Golongan II A (logam alkali tanah) terdiri dari dari unsur-unsur yang memiliki elektron valensi 2 dengan subkulit terakhir s. Unsur-unsur yang termasuk golongan ini adalah Be, Mg, Ca, Sr, Ba, dan Ra.
- Golongan III A terdiri dari unsur-unsur yang memiliki elektron valensi 3 dengan subkulit terakhir p. Itulah mengapa, golongan ini diletakkan pada blok p. Unsur-unsur IIIA terdiri dari B, Al, Ga, In, Tl, dan Uut.
- Golongan IV A terdiri dari unsur-unsur yang memiliki elektron valensi 4 dengan subkulit terakhir p. Itulah mengapa, golongan ini juga diletakkan pada blok p. Unsur-unsur golongan 4 terdiri dari C, Si, Ge, Sn, Pb, dan Fl.
- Golongan V A terdiri dari unsur-unsur yang elektron valensinya 5 dengan subkulit terakhir p. Golongan ini terdiri dari N, P, As, Sb, Bi, dan Mc.
- Golongan VI A terdiri dari unsur-unsur yang memiliki elektron valensi 6 dengan subkulit terakhir p. Itulah mengapa, unsur golongan ini diletakkan pada blok p. Unsur VI A terdiri dari O, S, Se, Te, Po, dan Lv.
- Golongan VII A disebut juga golongan halogen. Unsur-unsur yang termasuk golongan halogen adalah F, Cl, Br, I, At, dan Ts.
- Golongan VIII A disebut juga golongan gas mulia. Susunan elektron valensi golongan gas mulia sudah mencapai kondisi oktet, yaitu 8, sehingga sulit bereaksi dengan unsur lain. Unsur gas mulia terdiri dari He, Ne, Ar, Kr, Xe, dan Rn.
- Golongan I – VIII B (golongan transisi) umumnya terdiri dari unsur-unsur logam transisi. Unsur-unsur yang termasuk golongan transisi memiliki elektron valensi yang terletak pada subkulit d. Itulah mengapa, golongan ini terletak pada blok d.
2. Periode
Periode adalah pengelompokan unsur berdasarkan kulit atom terakhir (banyaknya kulit) atau tingkat energinya. Jika golongan dilihat dari kolom vertikal (atas ke bawah), maka periode dilihat dari kolom horizontal (dari kiri ke kanan). Jika kulit terakhirnya 2, maka unsur tersebut termasuk unsur periode 2. Dalam satu periode, semakin ke kanan jari-jari atom semakin kecil. Artinya, keelektronegatifan unsur semakin besar.
3. Blok f (Lantanida dan Aktinida)
Blok f atau biasa disebut deret lantanida dan aktinida berisi unsur-unsur yang memiliki subkulit terakhir f. Lantas, apa perbedaan antara keduanya?
Deret lantanida tergolong sebagai logam tanah jarang. Bahkan, salah satu unsur pada deret ini bersifat radioaktif, yaitu prometium. Deret lantanida berisi 15 unsur yang memiliki nomor atom 57 – 71. Beberapa diantaranya adalah lantanum, serium, praseodimium, neodimium, prometium, dan masih banyak lainnya.
Deret aktinida terdiri dari 15 unsur yang memiliki nomor atom 89 – 103. Hampir semua unsur pada golongan ini bersifat radioaktif. Contoh yang paling terkenal adalah uranium dan torium. Hanya kedua unsur tersebut yang bisa ditemukan secara alami di Bumi. Lainnya? Buat PR, ya!
Jenis-Jenis Unsur pada Tabel Periodik
Tabel periodik memuat berbagai jenis unsur, mulai logam, semilogam, logam transisi, logam post transisi, hingga nonlogam. Lantas, mana saja pembagian unsur-unsur tersebut? Perhatikan gambar berikut.
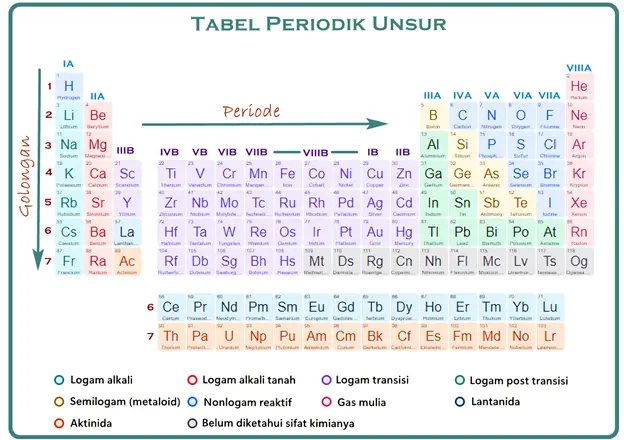
1. Unsur logam
Unsur logam pada tabel periodik dibagi menjadi empat, yaitu logam utama, logam transisi, logam post transisi, dan deret aktinida-lantanida. Apa perbedaan antara keempat logam tersebut?
A. Logam utama
Unsur logam utama berada di golongan A, yakni I A (logam alkali) dan II A (logam alkali tanah). Kedua logam ini bersifat reaktif karena memiliki elektron valensi yang relatif lebih sedikit dibandingkan logam transisi. Jika dibandingkan logam transisi, logam utama ini bersifat lebih lunak dengan titik leleh dan titik didih yang relatif lebih rendah.
B. Logam transisi
Logam transisi (ditunjukkan oleh warna ungu) berada di golongan I B – VIII B. Salah satu unsur logam transisi yang umum Quipperian kenal adalah besi. Jika dibandingkan logam utama, logam transisi ini bersifat lebih keras namun sulit untuk bereaksi karena memiliki elektron valensi lebih banyak.
C. Logam post transisi
Logam post transisi ini berada di antara golongan unsur metaloid dan unsur logam transisi. Titik leleh dan titik didihnya relatif lebih rendah dari logam transisi dan bersifat lebih lunak. Contoh logam post transisi adalah Pb (timbal), Bi (bismuth), Al (aluminium), Ga (gallium), dan sebagainya.
D. Deret lantanida dan aktinida
Kedua deret tersebut termasuk logam, lho. Untuk lantanida cukup jarang ditemukan meskipun jumlahnya cukup melimpah di kerak Bumi. Tidak menutup kemungkinan, logam tanah jarang ini bisa dikembangkan di masa mendatang. Sementara itu, aktinida erat kaitannya dengan pengembangan nuklir, sehingga sulit dijangkau oleh kimia terapan.
2. Unsur semilogam
Unsur semilogam (ditunjukkan oleh warna kuning keemasan) juga biasa disebut metaloid. Mengapa disebut semilogam? Karena sifat-sifat unsurnya merupakan perpaduan antara logam dan nonlogam. Unsur-unsur ini biasa dimanfaatkan sebagai bahan semikonduktor. Contohnya, Si (silicon), Ge (germanium), B (boron), dan sebagainya.
3. Unsur nonlogam
Unsur nonlogam berada di golongan A, yaitu I A (hidrogen), IV A (karbon), V A (nitrogen dan fosfor), VI A (oksigen, sulfur, dan selenium), VII A (fluor, klor, brom, iodin), dan semua golongan VIII A. Semua unsur nonlogam, selain VIII A, bersifat reaktif atau mudah berikatan dengan unsur lain.
Tips Menghafal Nama-Nama Unsur dalam Satu Golongan pada Tabel Periodik
Mungkin Quipperian penasaran, bagaimana cara menghafal nama-nama unsur yang sedemikian banyaknya? Berikut ini tips mudah untuk menghafalnya ya.
1. Buat susunan kalimat singkat untuk memudahkan dalam menghafal.
Misalnya untuk unsur golongan IA yang terdiri dari H, Li, Na, K, Rb, Cs, Fr, kamu bisa membuat kalimat singkat yang memuat nama unsurnya, yaitu Hari Libur Nanti Ku Rebut Cinta si Frido. Hal itu bisa kamu lakukan untuk unsur golongan yang lain.
2. Berilah highlight untuk unsur-unsur yang biasa keluar pada soal.
Misalnya, Na, Cl, O, H, Li, Br, K, Mg, Ca, dan unsur reaktif lainnya. Dengan highlight tersebut, kamu bisa lebih mudah menentukan letak golongan dan periodenya serta reaksi yang mungkin terjadi.
Cara Menentukan Golongan dan Periode Unsur pada Tabel Periodik
Di artikel sebelumnya, Quipper Blog sudah pernah membahas tentang konfigurasi elektron. Ternyata, konfigurasi itu bisa membantu Quipperian dalam menentukan golongan atau periode suatu unsur, lho. Misalnya, diketahui suatu unsur X memiliki nomor atom 8. Kira-kira, unsur X tersebut berada di golongan dan periode berapa ya?
Yuk, kita cari bersama-sama!
Mula-mula, kamu harus mengonfigurasikan nomor atom unsur X.
8X = 1s22s22p4
Oleh karena subkulit terakhirnya p, maka unsur X berada di blok p. Sementara itu, elektron valensi unsur X adalah 6 (s2 p4), sehingga unsur tersebut berada di golongan VI A. Lantas, bagaimana dengan periodenya? Unsur X memiliki jumlah kulit = 2. Artinya, unsur X berada di periode 2.
Dengan demikian, unsur X berada di golongan VI A dan periode 2.
Kesimpulan
Dari pembahasan di atas, dapat disimpulkan bahwa tabel periodik terdiri dari golongan, periode, dan blok f (yang notabene terpisah dari unsur logam lain). Jenis unsur yang berada pada tabel periodik terdiri dari unsur logam, semilogam, dan nonlogam.
Itulah pembahasan Quipper Blog kali ini. Semoga bermanfaat, ya. Jika Quipperian ingin melihat pembahasan lengkapnya oleh tutor, yuk buruan gabung Quipper Video. Bersama Quipper Video, belajar jadi lebih mudah. Salam Quipper!
