Quipperian, pernahkah kamu mencicipi rasa cuka dapur atau kapur sirih? Bagaimana rasanya? Tentu, cuka dapur terasa asam, sedangkan kapur sirih terasa pahit.
Cuka dapur dan kapur sirih ini merupakan contoh dari asam dan basa. Asam dan basa sendiri merupakan larutan elektron dengan ciri khas rasa masam untuk larutan asam dan pahit untuk larutan basa.
Ada beberapa teori asam basa yang dikemukakan oleh para ahli. Apa saja itu? Apa keunggulan dari setiap teori asam basa menurut para ahli tersebut? Berikut ulasan lengkapnya.
Pengertian Asam dan Basa
Sebelum kita membahas teori asam basa menurut para ahli, sudahkah kamu memahami apa itu asam dan basa? Apakah pengertian asam dan basa hanya sebatas larutan dengan rasa yang masam dan pahit saja? Tentu tidak, ya Quipperian.
Asam dan basa adalah larutan elektrolit dengan ciri khas tersendiri. Secara kimia, asam dapat juga diartikan sebagai zat elektrolit yang apabila dilarutkan dalam air akan menghasilkan ion hidrogen (H+).
Sementara itu, basa adalah zat elektrolit yang dapat menghasilkan ion hidroksida (OH-) di dalam air.
Asam dan basa ini banyak kita jumpai dalam kehidupan sehari-hari. Contohnya, air jeruk, asam cuka, air aki, dan minuman berkarbonasi yang merupakan contoh zat yang mengandung asam, sedangkan sabun, sampo, larutan amonia, dan deterjen adalah contoh zat yang mengandung basa.
Untuk mengetahui suatu zat bersifat asam atau basa kamu tidak harus selalu mencicipi rasanya karena beberapa zat asam maupun basa ada yang bersifat racun dan korosif. Kamu bisa mengetahui suatu zat bersifat asam atau basa ini melalui teori asam basa yang dikemukakan oleh para ahli.
Teori Asam Basa Menurut Ahli
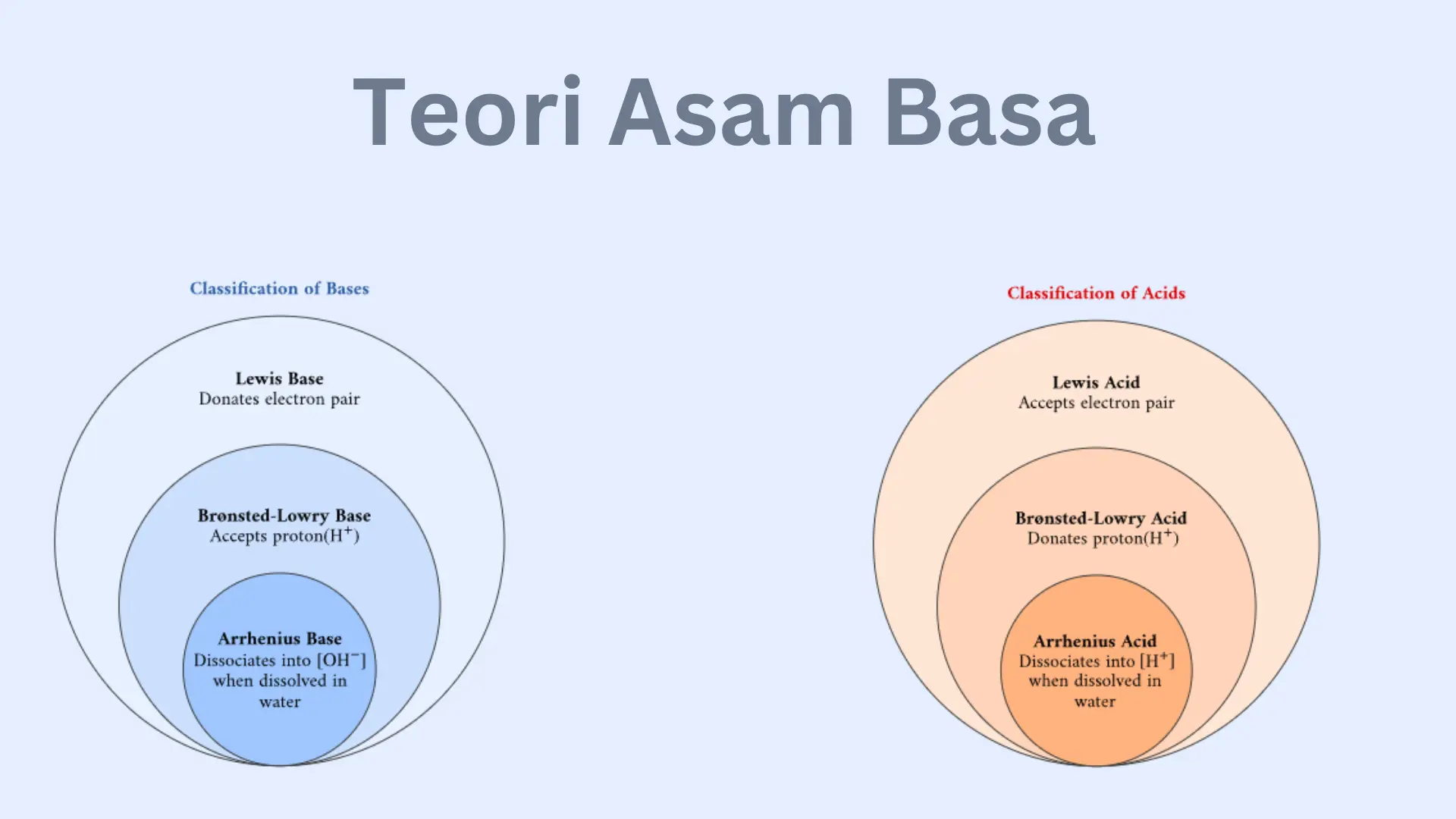
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.
Teori Asam Basa Arrhenius
Svante Arrhenius adalah seorang ilmuwan asal Swedia yang telah berhasil mengemukakan teori asam dan basa pada tahun 1884. Teori asam basa yang dikemukakan oleh Arrhenius ini sangat memuaskan sehingga masih dapat diterima hingga saat ini.
Menurut Arrhenius, asam adalah suatu senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidrogen (H+), sedangkan basa adalah senyawa yang apabila dilarutkan dalam air akan melepaskan ion hidroksida (OH-).
Dalam teori ini, ion hidrogen (H+) adalah pembawa sifat asam dan ion hidroksida (OH-) sebagai pembawa sifat basa.
Contoh asam menurut Arrhenius adalah senyawa HCl yang apabila dilarutkan dalam air akan terionisasi menjadi:
HCl(g) + H2O(l) → Cl-(aq) + H3O+(aq)
Dalam reaksi di atas, HCl melepaskan H+ ke air sehingga menghasilkan ion hidronium (H3O+).
Adapun contoh basa menurut teori asam basa Arrhenius adalah senyawa NaOH yang apabila dilarutkan dengan air akan terionisasi menjadi:
NaOH(aq) → Na+(aq) + OH-(aq)
Teori Asam Basa Bronsted Lowry
Tahun 1923, seorang ahli dari Denmark bernama Johanes N. Bronsted dan Thomas M. Lowry dari Inggris mengajukan konsep tentang asam basa secara terpisah, tapi dalam waktu bersamaan. Konsep ini kemudian dikenal dengan teori asam basa Bronsted Lowry.
Bronsted dan Lowry mendefinisikan asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H+).
Menurut teori asam basa Bronsted Lowry, asam adalah zat yang cenderung mendonorkan ion H+, sedangkan basa adalah zat yang cenderung menerima ion H+ dari zat lain.
Dua ilmuwan ini juga mencetuskan teori asam basa konjugasi. Asam konjugasi adalah basa yang menerima ion H+, sedangkan basa konjugasi adalah asam yang telah mendonorkan atau melepaskan ion H+.
Sebagai contoh, ketika asam asetat (CH3COOH) dilarutkan dalam air, maka akan terjadi reaksi berikut ini.
Berdasarkan reaksi di atas, CH3COOH adalah asam karena dapat memberikan ion H+ kepada H2O. Sementara CH3COO- adalah basa karena menerima ion H+. Basa tersebut adalah basa konjugasi.
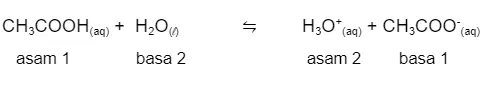
Sementara H3O+ adalah asam konjugasi karena kelebihan ion H+ dibandingkan zat asalnya, yaitu H2O. Pasangan CH3COOH dan CH3COO- disebut pasangan asam basa konjugasi.
Dalam teori asam basa Bronsted Lowry, ada kondisi dan reaksi tertentu di mana suatu senyawa dapat berperan sebagai basa meskipun tidak mengandung OH-, sedangkan dalam reaksi lainnya senyawa tersebut berperan sebagai basa. Senyawa yang memiliki sifat amfiprotik dan berperan sebagai amfoter.
Teori Asam Basa Lewis
Meskipun teori asam basa sudah dijelaskan dengan cukup luas oleh Bronsted dan Lowry, tetapi teori ini tidak mampu menjelaskan zat-zat yang tidak mengandung atom hidrogen dan bersifat asam. Oleh karena itu, pada tahun 1932, Gilbert N. Lewis, seorang kimiawan asal Amerika Serikat mengemukakan teori asam basa yang lebih luas dibandingkan dua teori sebelumnya yang kemudian dikenal dengan teori asam basa Lewis.
Menurut Lewis, asam basa adalah reaksi yang berkaitan dengan proses serah terima (transfer) elektron. Asam menurut Lewis adalah zat yang dapat menerima pasangan elektron dari zat lain, sedangkan basa adalah zat yang memiliki pasangan elektron bebas dan mampu mendonorkannya ke zat lain.
Kelebihan dan Kekurangan Setiap Teori Asam Basa
Setiap teori asam basa yang dikemukakan oleh para ahli memiliki kelebihan dan kekurangan masing-masing. Berikut adalah kelebihan dan kekurangan tersebut
Kelebihan dan Kekurangan Teori Asam Basa Arrhenius
Adapun kelebihan teori asam basa Arrhenius adalah teori ini dapat menyempurnakan teori asam basa sebelumnya, yaitu teori asam basa Liebig. Menurut Arrhenius, hidrogen tidak hanya terdapat dalam zat asam saja, tapi basa juga memiliki hidrogen.
Sementara kekurangan dari teori ini adalah hanya menjelaskan senyawa-senyawa yang dapat memiliki rumus kimia HnX untuk asam dan L(OH)n untuk basa.
Selain itu, teori asam basa menurut Arrhenius juga tidak dapat menjelaskan mengapa HCl bersifat asam dalam larutan encernya, serta CO2 dalam air bersifat asam atau NH3 dalam air bersifat basa.
Kekurangan lain yang dimiliki oleh teori asam basa Arrhenius ini adalah hanya terbatas pada senyawa yang dilarutkan dalam air saja.
Kelebihan dan Kekurangan Teori Asam Basa Bronsted Lowry
Sama seperti teori asam basa yang dikemukakan oleh Arrhenius, teori asam basa menurut Bronsted Lowry juga memiliki kelebihan dan kekurangan tersendiri.
Teori ini memiliki kelebihan dalam hal cangkupannya yang lebih luar di mana tidak terbatas pada senyawa yang dilarutkan dalam air saja, tapi juga dapat menjelaskan reaksi asam basa dalam pelarut lain, bahkan reaksi tanpa pelarut.
Teori asam basa Bronsted Lowry juga tidak hanya berupa molekul saja, tapi juga bisa berupa molekul, senyawa ion, dan ion (kation dan anion).
Selain itu, teori ini juga dapat menjelaskan mengapa NH4Cl bersifat asam. Hal ini dikarenakan ion NH4+ melepaskan ion H+ ketika berada di dalam air sehingga menyebabkan NH4Cl bersifat asam.
Sementara itu, kekurangan dari teori asam basa yang dikemukakan oleh Bronsted Lowry adalah teori ini tidak mampu menjelaskan zat-zat yang tidak mengandung atom hidrogen, tapi bersifat asam, seperti BF3, SO3, dan Al3+.
Kelebihan dan Kekurangan Teori Asam Basa Lewis
Terakhir, kelebihan dan kekurangan teori asam basa Lewis. Teori ini mampu menjelaskan sifat asam atau basa dalam pelarut lain, bahkan tanpa pelarut.
Teori asam basa Lewis juga dapat menjelaskan sifat asam basa molekul atau ion yang memiliki pasangan elektron bebas atau yang dapat menerima elektron bebas.
Kelebihan lain yang dimiliki oleh teori asam basa ini adalah dapat menjelaskan sifat basa pada zat-zat organik, seperti DNA dan RNA yang mengandung atom nitrogen dan memiliki pasangan elektron bebas.
Sayangnya, teori asam basa Lewis ini tidak dapat menjelaskan kekuatan relatif asam dan basa, serta beberapa asam Lewis juga tidak memiliki sifat katalitik. Inilah yang menjadi kekurangan dari teori asam basa Lewis.
Demikian pembahasan mengenai teori asam basa menurut para ahli beserta kelebihan dan kekurangan yang dimiliki oleh masing-masing teori. Semoga bermanfaat!
Referensi:
Parning, Horale, dan Tiopan. 2006. Kimia 2B. Jakarta: Penerbit Yudhistira
Riyanto, Nurdin dan Ari Yustisia Akbar. 2009. Super Jenius Olimpiade Kimia SMA Nasional dan Internasional. Yogyakarta: Penerbit Pustaka Widyatama
Harnanto, Ari dan Ruminten. 2009. Kimia 2 : Untuk SMA/MA Kelas XI. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Utami, Budi, dkk. 2009. Kimia untuk SMA dan MA Kelas XI. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
Premono, Shidiq, Anis Wardani, dan Nur Hidayat. 2009. Kimia : SMA/ MA Kelas XI. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional
