Hai Quipperian, di artikel sebelumnya, Quipper Blog sudah pernah membahas tentang pengertian stoikiometri, pereaksi pembatas, sampai senyawa hidrat. Apakah kamu masih ingat bagaimana langkah penyelesaian soal stoikiometri? Yuk, simak contoh soal berikut ini.
Contoh Soal 1
Jika rumus molekul cuka adalah CH3COOH, rumus empirisnya adalah
- CH2O
- CHO
- CHO2
- C2HO
- CHO3
Pembahasan:
Rumus empiris merupakan bentuk paling sederhana dari rumus molekul. Artinya, terdapat faktor pengali yang menghubungkan rumus empiris dan rumus molekul. Secara matematis, dirumuskan sebagai berikut.
Rumus molekul = (Rumus empiris)n
↔CH3COOH = (Rumus empiris)n
↔C2H4O2 = (CH2O)2
Jadi, rumus empiris cuka adalah CH2O
Jawaban: A
Contoh Soal 2
Rumus empiris fruktosa adalah CH2O. Jika massa molekul relatif fruktosa tersebut adalah 180, rumus molekulnya adalah …. (Ar H = 1, C = 12, dan O = 16)
- C6H12O6
- C4H12O6
- C3H6O3
- C2H4O2
- C4H12O4
Pembahasan:
Mula-mula, kamu harus menentukan massa molekul relatif (Mr) dari rumus empiris fruktosa, yaitu CH2O.
Mr = ( 1 × Ar C) + (2 × Ar H) + (1 × Ar O)
= 12 + (2×1) + 16
= 30
Lalu, tentukan variabel pengali rumus empirisnya.
n × Mr rumus empiris = Mr rumus molekul
n × 30 = 180
n = 180 : 30= 6
Dengan demikian, rumus molekulnya bisa dinyatakan sebagai berikut.
Rumus molekul = (rumus empiris)n
= (CH2O)6
= (C6H12O)6
Jadi, rumus molekul fruktosa adalah (C6H12O)6
Jawaban: A
Contoh Soal 3
Pada suatu percobaan, terdapat sampel freon yang terdiri dari 0,423 gr C, 2,503 gr Cl, dan 1,339 gr F. Rumus empiris freon tersebut adalah …. (Ar F = 19, C = 12, dan Cl = 35,5)
- CClF2
- CCl2F
- C2Cl2F2
- CCl2F3
- CCl2F2
Pembahasan:
Diketahui:
m C = 0,423 gr
m Cl = 2,503 gr
m F = 1,339 gr
Ditanya: rumus empiris freon = … ?
Jawab:
Untuk mencari rumus empiris freon, gunakan perbandingan mol antara ketiga unsur.

Jadi, rumus empiris freon adalah CCl2F2
Jawaban: E
Contoh Soal 4
Perhatikan persamaan reaksi berikut
Fe2O3 + 3CO → 2Fe + 3CO2
Dari reaksi tersebut, ternyata dihasilkan 224 gr besi. Massa besi (III) oksida yang bereaksi adalah …. (Ar Fe = 56, C = 12, dan O = 16)
- 560 gr
- 300 gr
- 240 gr
- 320 gr
- 450 gr
Pembahasan:
Diketahui:
m Fe = 224 gr
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Ditanya: m Fe2O3 = ?
Jawab:
Mula-mula, kamu harus menentukan mol dari Fe
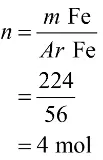
Lalu, tentukan mol besi (III) oksida melalui perbandingan koefisien.

Dengan demikian, diperoleh massa besi (III) yang bereaksi sebagai berikut.
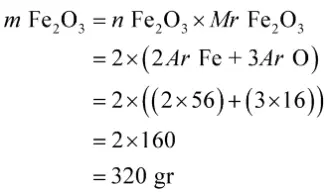
Jadi, massa besi (III) oksida yang bereaksi adalah 320 gr
Jawaban: D
Contoh Soal 5
Seorang peneliti mereaksikan 8,1 gr aluminium dengan asam klorida. Reaksi tersebut menghasilkan aluminium klorida dan gas hidrogen. Pada suhu dan tekanan tertentu, 1 mol gas hidrogen memiliki volume 6 liter. Adapun persamaan reaksinya adalah sebagai berikut.
2Al + 6HCl → 2AlCl3 + 3H2
Volume gas hidrogen yang dihasilkan pada reaksi tersebut adalah …. (Ar Al = 27)
- 1,8 liter
- 2,7 liter
- 5,4 liter
- 4,5 liter
- 4,8 liter
Pembahasan:
Mula-mula, kamu harus menentukan jumlah mol aluminium (Al)

Selanjutnya, tentukan jumlah mol H2 melalui perbandingan koefisien seperti berikut.

Terakhir, tentukan volume gas hidrogen yang dihasilkan pada reaksi tersebut dengan perbandingan seperti berikut.
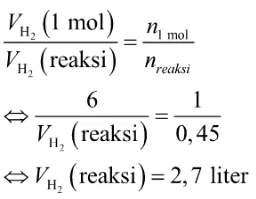
Jadi, volume gas hidrogen yang dihasilkan pada reaksi tersebut adalah 2,7 liter.
Jawaban: B
Contoh Soal 6
Suatu reaksi berlangsung seperti persamaan berikut
X + 2Y → XY2
Massa kedua unsur yang direaksikan sama, yaitu 150 gr. Persen massa unsur yang tersisa adalah …. (Ar X = 15, Y = 30)
- 60%
- 50%
- 75%
- 80%
- 45%
Pembahasan:
Mula-mula, kamu harus menentukan jumlah mol unsur X dan Y.
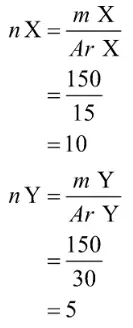
Lalu, kamu harus menentukan pereaksi pembatas pada reaksi tersebut. Pereaksi pembatas diperoleh dari hasil bagi unsur yang terkecil.
X = 10 / 1 = 10
Y = 5/2 = 2,5
Dari perhitungan di atas, diketahui bahwa unsur Y akan habis bereaksi atau menjadi pereaksi pembatas. Perhatikan tabel berikut.
| x (mol) | + | 2Y(mol) | → | XY2(mol) | |
|---|---|---|---|---|---|
| Mula-mula | 10 | 5 | – | ||
| Reaksi | 1/2×5 = 2,5 | 5 | 1/2×5 = 2,5 | ||
| Sisa | 7,5 | – | 2,5 |
Dengan demikian, persen massa unsur X yang tersisa adalah sebagai berikut.

Jadi, persen massa unsur yang tersisa adalah 75%
Jawaban: C
Contoh Soal 7
Reaksi pembakaran 32 gram gas metana berlangsung seperti reaksi berikut
CH4 + 2O2 → CO2 + 2H2O
Jika massa oksigen yang digunakan pada pembakaran tersebut 160 gr, banyaknya mol H2O yang terbentuk adalah …. (Ar C = 12, O = 16)
- 4 mol
- 3 mol
- 2 mol
- 2,5 mol
- 5 mol
Pembahasan:
Mula-mula, kamu harus menentukan jumlah mol unsur metana (CH4) dan oksigen (O2).

Lalu, kamu harus menentukan pereaksi pembatas pada reaksi tersebut. Pereaksi pembatas diperoleh dari hasil bagi unsur yang terkecil.
CH4 = 2/1 = 2
O2 = 5/2 = 2,5
Dari perhitungan di atas, diketahui bahwa gas metana akan habis bereaksi atau menjadi pereaksi pembatas. Perhatikan tabel berikut.
| CH4(mol) | 2O2(mol) | → | CO2(mol) | 2H2O(mol) | |
|---|---|---|---|---|---|
| Mula-mula | 2 | 5 | – | – | |
| Reaksi | 2 | 4 | 2 | 4 | |
| Sisa | – | 1 | 2 | 4 |
Jadi, banyaknya mol H2O yang terbentuk adalah 4 mol
Jawaban: A
Contoh Soal 8
Kristal CuSO4 (Mr = 159,5)sebanyak 478,5 gr mampu menyerap 270 gram air. Akibatnya, terbentuk senyawa hidrat CuSO4.xH2O. Banyaknya molekul air yang terserap di dalam senyawa hidrat tersebut adalah
- 6
- 4
- 5
- 3
- 2
Pembahasan:
Mula-mula, kamu harus menentukan persamaan reaksinya seperti berikut
CuSO4 + xH2O → CuSO4.xH2O
Selanjutnya, tentukan jumlah mol CuSO4 dan H2O seperti berikut

Untuk mencari banyaknya molekul H2O pada senyawa hidrat CuSO4.xH2O, gunakan SUPER “Solusi Quipper” berikut.
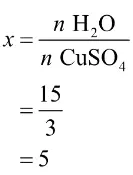
Jadi, banyaknya molekul air pada senyawa hidrat tersebut adalah 5
Jawaban: C
Contoh Soal 9
Suatu senyawa hidrat MSO4.5H2O dikeringkan sehingga massanya berkurang 144 gram. Berapakah massa MSO4 (Mr = 136) dalam senyawa hidrat tersebut?
Pembahasan:
Di soal tertulis bahwa massa senyawa hidrat akan berkurang 144 jika dikeringkan. Massa yang berkurang itu = massa air. Dengan demikian, kamu bisa menentukan jumlah mol airnya.

Lalu, tentukan jumlah mol MSO4 dengan cara SUPER “Solusi Quipper” berikut.
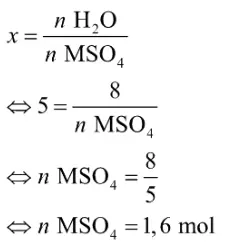
Terakhir, tentukan massa MSO4 dengan cara berikut.
mMSO4 = n MSO4 x Mr =1,6x 136 = 217,6 gramJadi, massa MSO4 (Mr = 136) dalam senyawa hidrat tersebut adalah 217,6 gram.
Contoh Soal 10
Unsur Z mampu membentuk senyawa dengan unsur O membentuk Z2O3. Jika massa unsur Z = 3,2 gr dan massa unsur O = 9,6 gr, berapakah massa atom relatif Z? (Ar O = 16)
Pembahasan:
2Z + 3O → Z2O3
Selanjutnya, tentukan jumlah mol O.
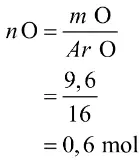
Lalu, tentukan mol unsur Z melalui perbandingan koefisien

Dengan demikian, massa atom relatif Z bisa dinyatakan sebagai berikut

Jadi, massa atom relatif Z adalah 8
Itulah pembahasan Quipper Blog kali ini. Semoga bermanfaat, ya. Untuk melihat contoh soal lainnya, yuk buruan gabung Quipper Video. Bersama Quipper Video, belajar jadi lebih mudah dan menyenangkan. Salam Quipper!