
Halo Quipperian! Kali ini Quipper Blog akan membahas materi Kimia yang menarik, nih, yaitu sel elektrolisis. FYI, soal-soal materi ini sering sekali keluar saat UN Kimia dan Soal SBMPTN. Jadi, be ready ya dan benar-benar matangkan materi ini sebelum kamu menghadapi ujian-ujian sekolah.
Nah, sebenarnya, apa sih sel elektrolisis itu? Apa saja aplikasinya di dunia nyata? Apa perbedaanya dengan sel volta ? Terus, bagaimana rumusannya? Tips dan trik apa saja yang harus dilakukan untuk dapat menyelesaikan soal-soalnya dengan cepat dan tepat? Daripada galau nyari jawaban atas pertanyaan-pertanyaan di atas, yuk simak nih jabaran lengkap Quipper Blog!
Apa Itu Sel Elektrolisis?

Sel elektrolisis adalah sel elektrokimia yang reaksi Reduksi-Oksidasinya terjadi karena adanya bantuan listrik. Aplikasi sel ini di dunia nyata untuk produksi zat, melakukan penyepuhan (electroplating) dan pemurnian logam. Kita dapat memproduksi unsur-unsur baru menggunakan sel elektrolisis seperti logam-logam, halogen-halogen, gas hidrogen, dan gas oksigen.
Penyepuhan (electroplating) adalah pelapisan permukaan suatu logam dengan logam lain. Contoh proses penyepuhan adalah pembuatan sendok alumunium dengan pelapisan menggunakan perak. Sedangkan contoh dari pemurnian logam adalah pemurnian tembaga (Cu) pada kabel listrik.
Untuk membuat kabel-kabel listrik yang di dalamnya terdapat tembaga. Logam tembaga yang dipakai harus betul-betul murni, sebab pengotoran sekecil apapun dapat mengurangi konduktivitas kabel tersebut sehingga nilai tegangan listriknya dapat berkurang.
Apa Bedanya dengan Sel Volta?

Ada 5 hal yang membedakan jenis elektrokimia ini, yaitu:
- Jenis perubahan energi. Sel volta berfungsi untuk mengubah energi kimia menjadi energi listrik sedangkan sel elektrolisis untuk mengubah energi listrik menjadi energi kimia.
- Terjadinya reaksi reduksi-oksidasi (redoks). Pada sel volta, reaksi redoks terjadi secara spontan begitu batang logam dimasukkan ke dalam sel. Sedangkan sel elektrolisis, reaksi redoks hanya terjadi ketika arus listrik dilewatkan ke sel ini.
- Pembagian sel. Pada sel volta, bagiannya terdiri dari 2 bagian terpisah yang dihubungkan dengan pori-pori. Sedangkan sel elektrolisis, hanya memiliki 1 bagian dimana sel kimia yang akan mengalami elektrolisis ditempatkan.
- Sifat dari anoda dan katoda. Pada sel volta, anoda bersifat negatif dan katoda bersifat positif sedangkan pada sel elektrolisis, anoda bersifat positif dan katoda bersifat negatif.
- Sumber elektron. Pada sel volta, elektron berasal dari larutan atau senyawa yang mengalami oksidasi. Sedangkan sel elektrolisis, elektron berasal dari sumber arus listrik di luar sel agar bisa terjadi reaksi kimia.
Prinsip Kerja Sel Elektrolisis

Prinsip kerjanya adalah sebagai berikut: Arus listrik dari sumber arus searah (Direct Current) mengalir ke dalam larutan elektrolit melalui katoda (sumbu negatif ) ke anoda (sumbu positif).
Pada katoda terjadi reaksi reduksi dari suatu unsur dan unsur yang lain mengalami oksidasi di anoda. Dari proses keduanya dihasilkan zat baru. Elektroda yang digunakan pada sel elektrolisis dapat bermacam-macam yaitu Cu, C (grafit), dan Pt. Rumus-rumusan di bawah ini menujukkan reaksi kimia pada sel elektrolisis menggunakan elektroda yang berbeda.
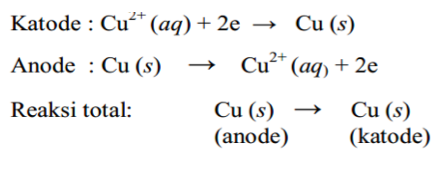
Reaksi sel elektrolisis CuSO4dengan elektroda Cu
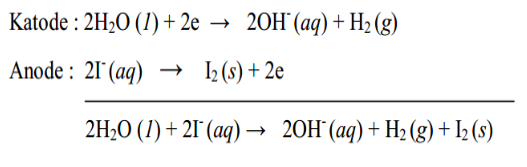
Reaksi sel elektrolisis larutan KI dengan elektroda C

Reaksi sel elektrolisis larutan Na2SO4dengan elektroda Pt
Rumus Hukum Faraday I dan Hukum Faraday II
Sel Elektrolisis ditemukan oleh fisikawan bernama Michael Faraday. Rumusannya menggunakan Hukum Faraday I dan Hukum Faraday II. Bunyi Hukum Faraday I adalah “Massa zat yang dihasilkan pada suatu elektroda selama proses elektrolisis berbanding lurus dengan muatan listrik yang digunakan”, sedangkan bunyi Hukum Faraday II adalah “Massa zat yang dihasilkan pada elektroda berbanding lurus dengan ekuivalen suatu zat.”
Oleh sebab itu, rumusan dari Hukum Faraday I dan II adalah sebagai berikut:

Rumus Matematis Hukum Faraday I
Di mana:
Q = muatan listrik (Coulomb)
i = kuat arus yang mengalir (Ampere)
t = waktu yang mengalir (Sekon)

Rumus Matematis Hukum Faraday II
Di mana:
G = Massa zat (Kg)
ME = Massa ekuivalen suatu zat
e = Jumlah mol elektron yang terbentuk
Tips Menyelesaikan Soal Sel Elektrolisis

Untuk menyelesaikan soal materi yang satu ini, ada beberapa tips dan triknya, nih. Apa saja?
- Tulis semua informasi dari soal yang diketahui (tujuannya agar kamu bisa mengidentifikasi soal).
- Tulis reaksi yang terjadi. Hafalkan unsur-unsur yang sering dipakai pada sel elektrolisis seperti (Cu2+berarti jumlah molnya 2) (Ag+berarti jumlah molnya 1) jumlah mol dapat dilihat dari ion dari unsur mereka. (Hal ini sangat penting karena dapat menentukan jumlah mol).
- Tulis pertanyaan dari soal lalu identifikasi soal (apakah diselesaikan dengan Hukum Faraday I atau Hukum Faraday II).
- Kenali tipe-tipe soal (Hukum Faraday I biasanya digunakan untuk mengetahui kuat arus yang mengalir pada sel elektrolisis atau waktu yang mengalir pada sel elektrolisis). Jangan khawatir Quipperian, untuk mengetahui variabel tersebut kita hanya perlu merubah variabel pada Hukum Faraday I saja.
- Hukum Faraday II biasanya digunakan untuk menjawab tipe soal perbandingan, di mana ada satu variabel soal yang tidak diketahui bisa berat ekuivalen atau massa hasil endapan.
- Ada tipe soal di mana kita harus menggabungkan Hukum I dan II Faraday. Soal tersebut biasanya menentukan massa endapan yang terbentuk di katoda. Karena 1 Faraday = 1 mol elektron dan 1 mol elektron sama dengan 1 muatan 96.500 Coulomb, persamaan menjadi:

Agar lebih memahami tips dan trik tersebut, Quipper Blog akan memberikan contoh soal dan pembahasannya, nih. Eits, jangan nyontek pembahasannya dulu sebelum kamu bisa jawab sendiri, ya!
Contoh Soal Nomor 1

Pembahasan:

Contoh Soal Nomor 2

Pembahasan:

Bagaimana Quipperian? Sudah mulai paham dengan materi Kimia yang satu ini? Kalau kamu masih mau ngerjain soal-soal lainnya, gabung yuk sama Quipper Video. Di sana kamu akan belajar sama tutor-tutor kece tentang materi apapun yang kamu rasa kurang paham. Buruan subscribe, ya! Sampai jumpa di artikel selanjutnya!
Sumber:
- Laurensius. 2013. Hukum Faraday. Malang: Universitas Negeri Malang.
- Dr. Suyanta. 2013. Redoks dan Elektrokimia. Jakarta: Kemdikbud.
- Wardaya College. Aplikasi Sel Elektrokimia. Jakarta.
Penulis: William Yohanes
