Hai Quipperian, sudah siapkah kamu menyambut seleksi akbar, SBMPTN? Atau justru kamu masih bingung mencari soal-soal SBMPTN? Bagi kamu yang saat ini masih bingung mencari soal-soal SBMPTN, tampaknya kamu berada di artikel yang tepat, nih. Kali ini, Quipper Blog akan membahas latihan soal SBMPTN Kimia TKA SAINTEK 2019. Kabar baiknya, latihan soal yang disediakan Quipper Blog, lengkap dengan jawaban beserta pembahasannya, lho. Semakin penasaran? Yuk, segera kerjakan soalnya!
(Mau soal latihan Kimia UTBK SBMPTN yang lebih lengkap? Dapatkan ribuan latihan soal dengan materi-materi di Paket Intensif Quipper Video! Info lebih lengkap cek https://www.quipper.com/id/video/paket-intensif/.)
Latihan Soal 1
Unsur A memiliki nomor massa 39 dan neutron 20, sedangkan unsur B memiliki nomor massa 32 dan neutron 16. Jika kedua unsur tersebut berikatan membentuk senyawa, rumus molekul dan jenis ikatan dari senyawa yang dihasilkan adalah…
- AB3, kovalen
- A3B, ion
- AB, ion
- A2B, ion
- AB2, kovalen
Jawaban: D
Pembahasan:
Diketahui:
- Nomor massa A = 39
- Neutron A = 20
- Nomor massa B = 32
- Neutron B = 16
Ditanya: Rumus molekul dan jenis ikatannya =…?
Penyelesaian:
Menghitung nomor atom (jumlah elektron):
- Elektron unsur A = 39 – 20 = 19
- Elektron unsur B = 32 – 16 = 16
Konfigurasi dan bentuk ion dari unsur A dan B:
19A: 1s2 2s2 2p6 3s2 3p6 4s1
Elektron valensi A=1
Agar stabil unsur A akan membentuk ion A+.
16B: 1s2 2s2 2p6 3s2 3p4
Elektron valensi B = 2 + 4 = 6
Agar stabil unsur B akan membentuk ion B2−.
Rumus molekul senyawa: A+ + B2− → A2B
Oleh karena terdapat ion positif dan ion negatif, senyawa yang dihasilkan memiliki ikatan ion.
Jadi, rumus molekul dan jenis ikatan dari senyawa yang dihasilkan adalah A2B dan ikatan ion.
Latihan Soal 2
Pemanasan 44,8 kristal besi (II) sulfat hidrat (FeSO4.xH2O) menghasilkan 30,4 gram kristal anhidrat. Jika massa molar FeSO4 = 152 g/mol dan Mr H2O = 18 g/mol, rumus molekul kristal hidrat tersebut adalah…
- FeSO4.3H2O
- FeSO4.H2O
- FeSO4.7H2O
- FeSO4.4H2O
- FeSO4.2H2O
Jawaban: D
Pembahasan:
Diketahui:
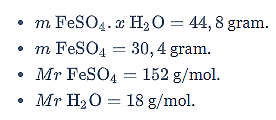
Ditanya: Rumus molekul senyawa hidrat =…?
Penyelesaian:
Reaksi pemanasan kristal berlangsung seperti di bawah ini.
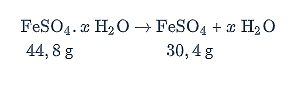
Berdasarkan Hukum Lavoisier, massa zat sebelum dan setelah reaksi sama, diperoleh:

Quipperian juga bisa menggunakan SUPER “Solusi Quipper” berikut ini.

Jadi, rumus molekul senyawa hidrat tersebut adalah FeSO4.4H2O.
Latihan Soal 3
Sebanyak 31,8 gram Na2CO3 direaksikan dengan XSO4 berlebih menurut persamaan reaksi berikut.

Jika dari reaksi tersebut dihasilkan 30 gram XCO3, massa atom relatif dari unsur X adalah … (Ar Na = 23; C = 12; S = 32; dan O = 16)
- 40 g/mol
- 39 g/mol
- 64 g/mol
- 100 g/mol
- 24 g/mol
Jawaban: A
Pembahasan:
Diketahui:
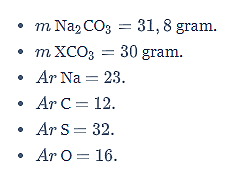
Ditanya: Ar X =…?
Penyelesaian:
Setarakan persamaan reaksi pada soal.
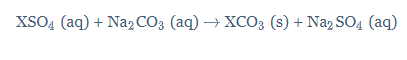
Lalu, hitunglah massa molekul relatif Na2CO3.
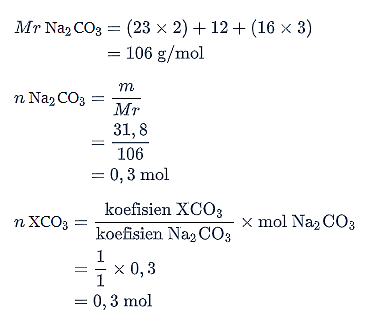
Selanjutnya, hitunglah massa molekul relatif XCO3.
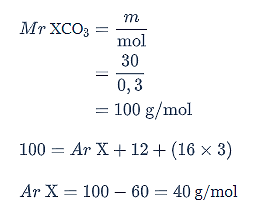
Jadi, massa atom relatif (Ar) dari unsur X adalah 40 g/mol.
Latihan Soal 4
Berikut ini merupakan data hasil titrasi Ba(OH)2 dengan larutan CH3COOH 0,2 M.
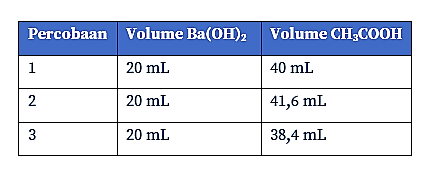
Jika massa jenis dan massa molar Ba(OH)2 berturut-turut adalah 1,2 g/mL dan 171 g/mol, kadar Ba(OH)2 dalam larutan adalah…
- 30,4%
- 28,5%
- 54%
- 50%
- 48,5%
Jawaban: B
Pembahasan:
Diketahui: Tabel hasil titrasi berikut.
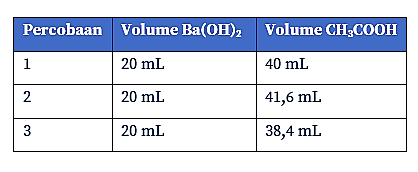
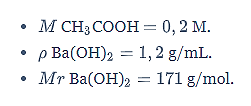
Ditanya: Kadar Ba(OH)2 dalam larutan =…?
Penyelesaian:
Pertama, kamu harus menghitung molaritas Ba(OH)2.
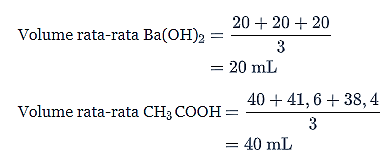
Pada titik ekuivalen berlaku persamaan berikut.
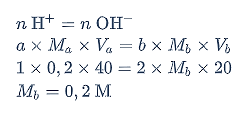
Kadar Ba(OH)2 bisa dihitung dengan persamaan berikut.
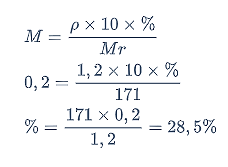
Jadi, kadar Ba(OH)2 dalam larutan adalah 28,5%.
Latihan Soal 5
Sebanyak 12 gram logam Magnesium (Ar Mg = 24) direaksikan dengan 50 mL larutan HCl 2 M (massa jenis = 1,2 g/mL). Larutan hasil reaksi mengalami kenaikan suhu sebesar 5o C. Jika kalor jenis larutan adalah 4,2 J.g/oC, perubahan entalpi reaksi tersebut adalah ….
- +15,12 kJ/mol
- -7,56 kJ/mol
- +7,56 kJ/mol
- +151,2 kJ/mol
- -15,12 kJ/mol
Jawaban: E
Pembahasan:
Diketahui:
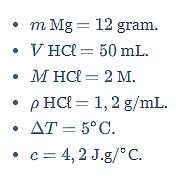
Ditanya: ∆H reaksi =…?
Penyelesaian:
Pertama, Quipperian harus menghitung kalor yang dihasilkan. Gunakan persamaan berikut.
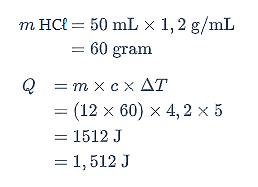
Selanjutnya, tentukan pereaksi pembatasnya.
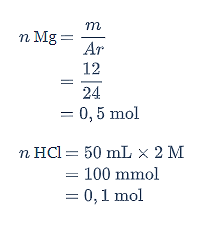
Persamaan reaksi setaranya adalah sebagai berikut.
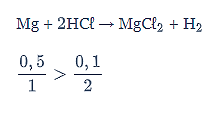
Oleh karena perbandingan mol HCl paling kecil, maka HCl menjadi pereaksi pembatas.
Barulah kamu bisa menentukan entalpi reaksinya.
Pada reaksi tersebut terjadi kenaikan suhu, sehingga jenis reaksinya adalah reaksi eksoterm dan perubahan entalpinya bernilai negatif.
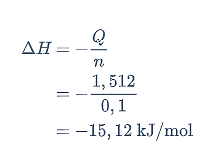
Jadi, perubahan entalpi reaksi tersebut adalah -15,12 kJ/mol.
Latihan Soal 6
Pada percobaan reaksi A + B → 2C, diperoleh data sebagai berikut.
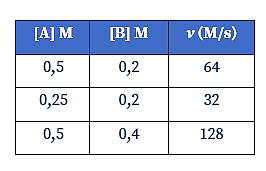
Harga tetapan laju untuk reaksi tersebut adalah…
- 320 M/s
- 32 M/s
- 160 M/s
- 64 M/s
- 640 M/s
Jawaban: E
Pembahasan:
Diketahui:
Pada percobaan reaksi A + B → 2C, diperoleh data sebagai berikut.
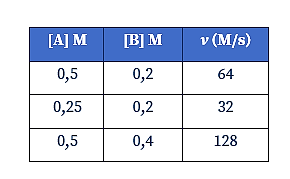
Ditanya: Harga tetapan laju reaksi (k) =…?
Penyelesaian:
Perhatikan persamaan laju reaksi berikut.
![]()
Selanjutnya, tentukan orde reaksinya (m dan n).
Untuk menentukan orde reaksi A (m), gunakan data percobaan (1) dan (2).
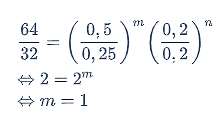
Untuk menentukan orde reaksi B (n), gunakan data percobaan (1) dan (3).
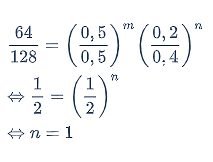
Untuk menentukan harga tetapan laju reaksi (k), gunakan data percobaan (1).
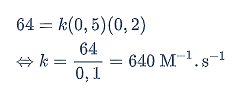
Jadi, harga tetapan laju reaksinya adalah 640 M/s.
Latihan Soal 7
Dalam wadah bervolume 2 L terjadi reaksi penguraian SO3 menurut persamaan reaksi berikut.
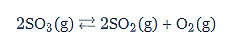
Jika SO3 terdisosiasi 75%, harga tetapan kesetimbangan untuk reaksi penguraian tersebut adalah…
- 6,25
- 6,75
- 2,25
- 1,25
- 3,75
Jawaban: B
Pembahasan:
Diketahui:
Reaksi penguraian SO3.
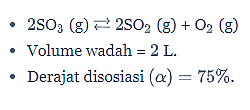
Ditanya: Harga tetapan kesetimbangan (Kc) =…?
Penyelesaian:
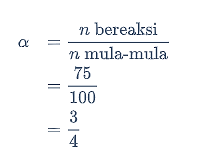
Reaksi kesetimbangan penguraian SO3.

Tentukan harga tetapan kesetimbangan dengan persamaan berikut.
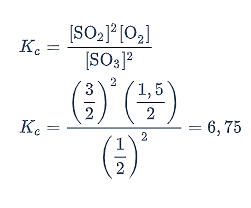

Jadi, harga tetapan kesetimbangan Kc untuk reaksi penguraian SO3 adalah 6,75.
Latihan Soal 8
Perhatikan reaksi disproporsionasi berikut.

Jika terdapat 6 mol Cl2 yang bereaksi, maka jumlah mol elektron yang terlibat adalah…
- 3 mol
- 5 mol
- 4 mol
- 6 mol
- 10 mol
Jawaban: E
Pembahasan:
Diketahui:
Reaksi disproporsionasi berikut.
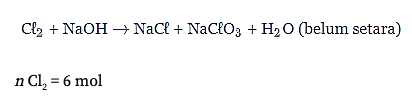
n Cl2 = 6 mol
Ditanya: Mol elektron yang terlibat =…?
Penyelesaian:
Setarakan terlebih dahulu reaksi disproporsionasi pada soal menggunakan cara biloks.
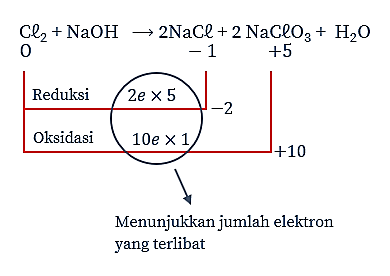
Reaksi setaranya adalah sebagai berikut.
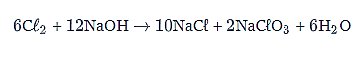
Jumlah elektron yang terlibat = 10.

Jadi, mol elektron yang terlibat adalah 10.
Latihan Soal 9
Suatu senyawa turunan alkana memiliki rumus molekul C4H10O. Senyawa tersebut dapat bereaksi dengan logam Natrium menghasilkan gas Hidrogen. Jika senyawa tersebut dioksidasi, akan dihasilkan asam karboksilat. Isomer fungsi dari senyawa yang dimaksud adalah…
- metoksi propana
- asam 2-metil propanoat
- 1-butanol
- Butanal
- 2-butanol
Jawaban: A
Pembahasan:
Diketahui:
Senyawa turunan alkana dengan rumus C4H10O. Sifat yang dimiliki senyawa tersebut adalah:
- dapat bereaksi dengan logam Natrium menghasilkan gas Hidrogen; dan
- jika dioksidasi dapat menghasilkan asam karboksilat.
Ditanya: Isomer fungsi senyawa turunan alkana tersebut =…?
Penyelesaian:
Rumus molekul C4H10O memiliki pola CnH2n+2O. Senyawa turunan alkana yang memiliki pola rumus molekul tersebut adalah alkohol (alkanol) dan eter (alkoksi alkana). Untuk sifat dari keduanya, ditunjukkan oleh tabel berikut.

Berdasarkan sifat-sifat tersebut senyawa turunan alkana yang dimaksud adalah alkohol. Pasangan isomer fungsi dari alkohol adalah eter. Berikut ini beberapa kemungkinan isomer fungsi dari senyawa tersebut.
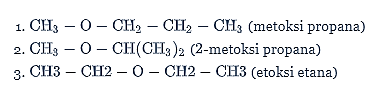
Jadi, isomer fungsi dari senyawa dengan rumus molekul C4H10O adalah metoksi propana.
Latihan Soal 10
Fenol merupakan salah satu senyawa turunan benzena yang bersifat asam. Fenol dapat mengalami reaksi substitusi dengan asam nitrat encer maupun pekat. Isomer dari senyawa yang dihasilkan dari reaksi fenol dengan asam nitrat encer adalah…
- p-nitro fenol
- m-nitro fenol
- p-hidroksi nitrobenzena
- m-hidroksi nitrobenzena
- o-nitro fenol
Jawaban: B
Pembahasan:
Diketahui:
Reaksi antara fenol dengan asam nitrat (HNO3) encer.
Ditanya: Isomer dari produk yang dihasilkan =…?
Penyelesaian:
Jika fenol direaksikan dengan HNO3 encer, akan terjadi substitusi atom H yang terikat oleh atom C nomor 2 atau 6 dan 4 dari cincin benzena dengan gugus nitro (−NO2). Berikut ini mekanisme reaksi fenol dengan asam nitrat encer.
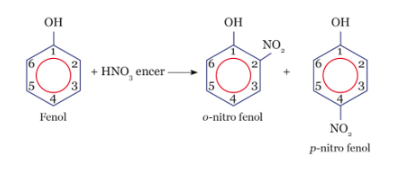
Produk yang dihasilkan memiliki struktur orto dan para. Benzena dengan 2 substituen (cabang) memiliki 3 bentuk isomer yaitu orto, meta, dan para.
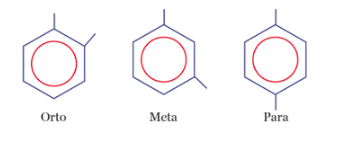
Jadi, isomer dari produk yang dihasilkan dari reaksi antara fenol dengan asam nitrat encer adalah m-nitro fenol.
Latihan Soal 11
Protein merupakan makromolekul yang tersusun dari monomer asam amino melalui reaksi polimerisasi kondensasi. Sebanyak n molekul asam amino alanin (CH3−CH(NH2)−COOH) mengalami polimerisasi menghasilkan polipeptida dengan massa molekul relatif 1.438 g/mol. Jumlah molekul alanin (n) yang membentuk polipeptida tersebut adalah…
(Ar: C = 12 g/mol; N = 14 g/mol; O = 16 g/mol; H = 1 g/mol)
- 40
- 60
- 30
- 20
- 100
Jawaban: D
Pembahasan:
Diketahui:

Ditanya: Jumlah molekul (n) alanin yang menyusun peptida =…?
Penyelesaian:
Polipeptida dihasilkan dari polimerisasi kondensasi dari asam amino. Pada reaksi kondensasi setiap penggabungan molekul asam amino disertai dengan pelepasan 1 molekul air (H2O). Tentukan Mr dari alanin dengan persamaan berikut.
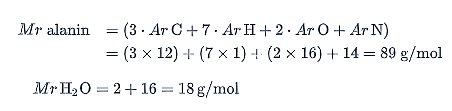
Menghitung jumlah molekul monomer:
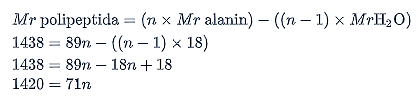
Jadi, jumlah molekul alanin yang menyusun polipeptida tersebut adalah 20 molekul.
Latihan Soal 12
Larutan urea dibuat dengan melarutkan 18 gram urea (Mr = 60) ke dalam air hingga volumenya menjadi 500 mL. Jika larutan urea tersebut isotonik dengan larutan elekrolit XCl2 0,4 M, harga derajat disosiasi dari XCl2 adalah…
- 0,60
- 0,80
- 0,75
- 0,25
- 0,50
Jawaban: D
Pembahasan:
Diketahui:

Ditanya: Derajat disosiasi (α) XCl2 =…?
Penyelesaian:
Larutan isotonik adalah larutan-larutan pada suhu yang sama akan memiliki tekanan osmotik yang sama pula.
Menentukan faktor Van’t Hoff:
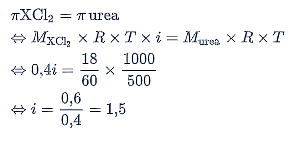
Menentukan derajat disosiasi XCl2.

Jadi, derajat disosiasi (α) XCl2 adalah 0,25.
Bagaimana Quipperian, apakah kamu sudah mulai paham mengerjakan latihan soal SBMPTN Kimia TKA SAINTEK 2019 di atas? Agar pemahamanmu semakin terasah, sering-seringlah belajar dan mengerjakan latihan soal.
Ingat, selangkah lagi kamu akan memasuki PTN impian. Untuk mendukung kesuksesanmu masuk PTN, Quipper Video hadir dengan Paket Intensif UTBK SBMPTN 2020. Semua kebutuhan sudah tersedia di dalamnya, mulai dari materi persiapan, materi pemantapan, latihan soal, bank soal, hingga pembahasan lengkapnya. Jadi, tunggu apalagi. Yuk, gabung Quipper Video sekarang!